Hückelovo pravidlo
Aby byla daná latka aromatická, musí být molekula planární, monocyklická, mít dokonale konjugovaný systém vazeb a splňovat právě onu Hückelovu podmínku. Ta říká, že počet pí-elektronů ve sloučenině musí být roven číslu 4n+2, tedy matematicky P= 4n+2, kde P je počet pí-elektronů a n je libovolné celé nezáporné číslo.
Ovšem proč zrovna 4n+2??? Co je na této kombinaci tak speciálního? Proč tedy zrovna 2, 6, 10, 14... pí-elektronů vede k aromaticitě a poměrně vysoké stabilitě, zatímco ostatní kombinace vedou k větší či menší nestabilitě. Odpověď se skrývá v "tajemné" teorii molekulových orbitalů (MO).
Pokud se totiž spočítají energetické hladiny molekulových orbitalů pro cyklické konjugované molekuly, ukáže se, že vždy existuje jeden nejníže ležící MO, nad kterým existují MO v degenerovaných párech. Tedy, při zaplňováníí MO je vždy potřeba dvou elektronů na zaplnění nejníže ležícího osamoceného MO a poté vždy čtyř elektronů na zaplnění každé z n následujících energetických hladin - dohromady tedy 2 + 4n. Každý jiný počet zanechá energetickou hladinu částečně nezaplněnou a tedy méně stabilní.
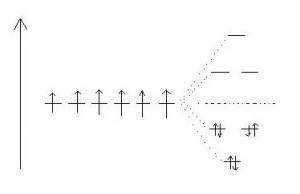
OBR: Molekulové orbitaly pro benzen:
1. Šipka vlevo ukazuje růst energie systému
2. Šest nedegenerovaných 2p atomových orbitalů (AO) šesti atomů uhlíku v cyklu benzenu s jedním elektronem v každém z nich
3. Při konjugaci a vzniku molekulových orbitalů vznikají tři vazebné MO o nižší energii než měly puvodní AO (dva jsou degenerované) a tři protivazebné MO o vyšší energii než měly původní AO (dva jsou opět degenerované)
4. Vazebné MO jsou zaplněny elektrony - je vidět, proč jich musí být právě 4n + 2 - tak dojde k zaplnění všech vazebných MO, kdyby jich byl jiný počet, některá místa by byla zbytečně volná.
Komentáře
Přehled komentářů
Mohla bych se zeptat, jaké je odůvodnění rozdílu aromaticity u cyklopropenu/-idu/-ylia, když jestli to chápu správně počet "pi-elektronu" je stejný?
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55
?
(inka , 2. 5. 2013 13:50)